[1. Service d’Hématologie-Oncologie pédiatrique, Clin. Univ. St-Luc, UCL, Bruxelles. 2. Service de Cardiologie pédiatrique, Clin. Univ. St-Luc, UCL, Bruxelles]
Les avancées thérapeutiques en oncologie pédiatrique permettent à un nombre important d’enfants d’être guéris et d’atteindre l’âge adulte. Cependant, les chimiothérapies utilisées et la radiothérapie sont potentiellement cardiotoxiques et contribuent à une morbidité et une mortalité significatives. Les accidents cardiovasculaires sont la cause principale de décès chez ces survivants.
Cette revue résume brièvement la physiopathologie des maladies cardiovasculaires liées aux traitements du cancer, leur incidence, ainsi que les facteurs de risque principaux. Actuellement, peu d’études sur les effets secondaires cardiaques au long cours chez les survivants d’un cancer ont été réalisées. Les études les plus significatives sont exposées dans cette revue et toutes démontrent un risque majoré de complications cardiaques par rapport à la population normale
Introduction
Le traitement du cancer pédiatrique est l’exemple d’une réussite médicale moderne qui a permis la guérison de maladies au départ incurables. Le taux de survie actuel à 5 ans pour tous types de cancers confondus est de plus de 80%. La prise en charge des séquelles secondaires aux traitements de cette population croissante de survivants de cancers pédiatriques est devenue le nouveau challenge des oncologues pédiatres (1, 2).
Le groupe Childhood Cancer Survivor Study (CCSS) rapportait que 30 ans après les traitements, l’incidence cumulative de problèmes de santé atteignait 73%, dont 42% de problèmes sévères ou de décès (3). Parmi ces problèmes chroniques sévères, on retrouvait la cardiotoxicité principalement liée à l’utilisation des anthracyclines et/ou de la radiothérapie médiastinale.
Cardiotoxicité des traitements anticancéreux utilisés en pédiatrie: résumé des connaissances actuelles
Incidence des effets secondaires cardiaques
L’incidence de la cardiotoxicité est estimée de façon très variable selon les études. La fréquence globale de cardiotoxicité varie de 0 à 16% lorsque seuls les patients souffrant d’insuffisance cardiaque sont étudiés, mais atteint 57% lorsque les patients présentant un dysfonctionnement cardiaque infraclinique sont inclus (4). De même, l’incidence cumulative de la morbidité cardiovasculaire après irradiation médiastinale a été estimée entre 0,3 et 22,8% (5). Le spectre des cardiopathies liées aux traitements du cancer allant de l’insuffisance cardiaque sévère à toute atteinte subclinique, l’incidence des complications augmente avec la sophistication des techniques d’imagerie. Ceci explique en partie les différences observées entre les études, mais l’hétérogénéité des doses d’anthracyclines et de radiations reçues ainsi que les différents temps de suivi des cohortes sont d’autres explications (6). En 2010, il a été démontré que le taux standardisé de mortalité pour les maladies cardiovasculaires chez les survivants de cancer pédiatrique (n = 4.122) était 5 fois supérieur à celui de la population générale (7).
Traitements cardiotoxiques: facteurs de risque et mécanismes d’action
Les toxicités cardiaques au long cours sont principalement dues aux anthracyclines et à la radiothérapie. Même si d’autres drogues sont également responsables de toxicité cardiaque aiguë ou subaiguë, nous nous concentrerons exclusivement sur ces deux traitements.
Anthracyclines
La cardiotoxicité induite par les anthracyclines est généralement classée en trois catégories: aiguë, chronique progressive à apparition précoce et chronique progressive à apparition tardive.
-
La toxicité aiguë liée aux anthracyclines se présente typiquement dans la première semaine de traitement. Elle est rarement observée (< 1%), généralement transitoire et réversible dès l’arrêt du traitement. Le risque de dysfonction chronique tardive semble plus élevé pour les patients diagnostiqués avec ce type de dysfonction aiguë (8).
-
L’apparition précoce d’une cardiomyopathie chronique progressive survient moins d’un an après le traitement. Elle est souvent prédictive de la cardiotoxicité tardive (9).
-
L’apparition tardive d’une cardiomyopathie chronique progressive se développe des années, voire des décennies après la fin du traitement (2).
Plusieurs facteurs de risque associés à l’apparition précoce et tardive de cardiotoxicité chronique progressive ont été identifiés. La dose cumulative est clairement le facteur prédictif le plus important (5). Bien que différents seuils au-dessus desquels la cardiotoxicité est plus susceptible de se développer ont été proposés (7, 8), des études récentes suggèrent qu’il n’existe pas de dose sécuritaire en deçà de laquelle la cardiotoxicité ne survient pas, en particulier pour les dysfonctionnements cardiaques chroniques tardifs (10, 12). Un suivi plus long après l’administration du médicament est associé à une plus grande prévalence de déficience cardiaque (5, 8). Le jeune âge (< 4-5 ans) (5, 9) et l’association avec une radiothérapie médiastinale favorisent aussi les effets secondaires cardiaques (5). Le sexe féminin est associé à un risque important de toxicité cardiaque (5-14), probablement parce que les anthracyclines sont mal absorbées par le tissu lipidique. En effet, comme les femmes ont un pourcentage plus élevé de tissu graisseux, ceci entraîne chez elles une concentration plus importante du médicament au niveau du muscle cardiaque. Une prédisposition génétique entraînant une diminution de la clearance de ces médicaments, la trisomie 21, la race noire, l’hyperthermie, les maladies du foie et une maladie cardiaque préexistante ont également été associées à un risque accru de cardiotoxicité (4).
De plus, parmi les patients ayant des facteurs de risque et des traitements similaires, on observe des variations dans la sensibilité à la toxicité des anthracyclines. Ceci suggère une composante génétique dans la réponse d’un individu aux anthracyclines. Récemment, divers gènes associés à la cardiotoxicité induite par les anthracyclines ont été identifiés. Dans le futur, le profil de risque génétique associé aux facteurs de risque cliniques pourrait aider à identifier les patients à haut risque de cardiotoxicité (15, 16) et donc permettre de mieux les dépister et de leur offrir un suivi plus personnalisé.
La physiopathologie de la toxicité des anthracyclines s’explique principalement par la production de radicaux libres endommageant les cardiomyocytes. Les myocytes cardiaques sont plus sensibles que d’autres types cellulaires aux lésions par les radicaux libres.
En analyse microscopique, les dommages des myocytes par les anthracyclines apparaissent sous forme de perte myofibrillaire, de fibrose et de dégénérescence vasculaire. La gravité de ces changements est en corrélation avec la dose totale d’anthracyclines reçue. Les myocytes pouvant rarement proliférer après l’âge de six mois, la croissance myocardique ne résulte que d’une augmentation de la taille des myocytes. Par conséquent, le principal moyen de compenser les myocytes perdus lors du traitement par les anthracyclines est une hypertrophie accrue des myocytes afin de maintenir l’architecture cardiaque et la fonction contractile. L’insuffisance cardiaque d’apparition tardive après un traitement par anthracyclines est due à l’incapacité des myocytes restants à compenser convenablement une surcharge cardiaque due à la croissance normale du corps, à une grossesse ou à d’autres contraintes métaboliques.
Radiothérapie
Toute radiothérapie médiastinale ou thoracique peut conduire à un dysfonctionnement cardiaque. Dans son étude, Tukenova a rapporté que le risque global de mourir d’une maladie cardiovasculaire est significativement majoré pour des personnes ayant reçu une dose moyenne de radiations supérieure à 5Gy (7). Mulrooney, quant à lui, démontre que l’exposition du cœur à des radiations de 15Gy ou plus augmente le risque relatif d’insuffisance cardiaque congestive, d’infarctus du myocarde, de maladies péricardiques et de pathologies valvulaires de 2 à 6 fois par rapport aux survivants non irradiés (6).
Ces dommages peuvent apparaître de manière progressive et les patients peuvent rester asymptomatiques pendant des années. La fibrose est la marque histopathologique de la maladie cardiaque induite par radiothérapie (16).
Etudes de suivi au long cours
L’intérêt du suivi au long cours des survivants d’un cancer pédiatrique a émergé au cours des 10 dernières années (3, 6-13, 17). Cependant, les cohortes des études étaient au départ hétérogènes en termes de critères d’inclusion, de durée de suivi, de technique de surveillance cardiovasculaire, d’âge moyen au moment du diagnostic, de doses et du type d’anthracyclines ou de doses de radiothérapie reçues.
Les principales études de suivi sont présentées selon la durée de suivi (Tableau 1). Cette liste n’est pas exhaustive, mais ces études ont été sélectionnées soit en raison de leur très long temps de suivi, soit en raison du grand nombre de patients inclus ou encore parce qu’elles apportent une information significative.
Les études incluant les plus grands nombres de patients sont celles du groupe du CCSS (Tableau 1-b), des cohortes française et anglaise (Tableau 1-c), et l’étude nordique (Tableau 1-d).
En 2001, les premières études de cohortes rétrospectives soulignaient déjà l’importance de la morbidité à long terme et de la mortalité cardiovasculaires chez les survivants d’un cancer pédiatrique (13). Elles montraient que le taux de mortalité globale augmentait avec le temps et était clairement au-dessus de la mortalité anticipée dans la population générale. De plus, ce taux de mortalité était significativement plus faible chez les patients traités au cours de la dernière période de l’étude (années 1980-89), ceci probablement en raison d’une meilleure prise de conscience de la toxicité de la chimiothérapie et d’une utilisation plus attentive de ces médicaments (13).
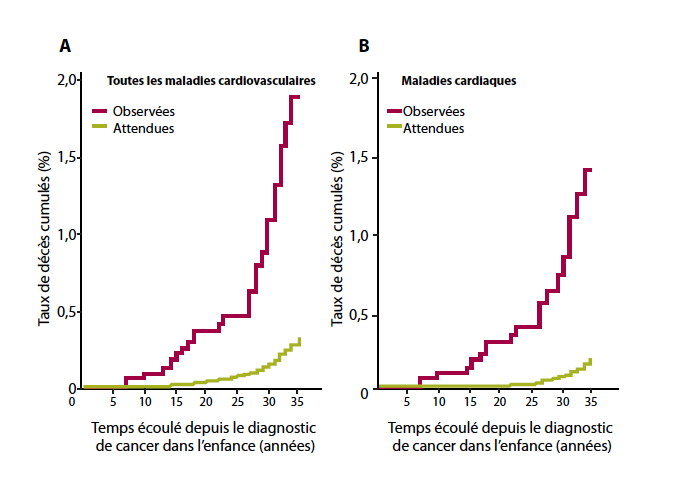
Mulrooney et al. (Tableau 1-b) ont démontré que l’incidence cumulative de morbidité cardiaque continuait à augmenter jusqu’à 30 ans après le diagnostic (6). En 2010, Kenney et al. (Tableau 1-a) ont publié une petite série de 107 patients ayant un suivi relativement long (18) et confirmaient que plus de 50 ans après la fin de la chimiothérapie et/ou radiothérapie, les survivants continuent d’être à risque de cardiopathie, avec une altération de la qualité de vie ou même une espérance de vie réduite. L’étude de Guldner (Tableau 1-e) démontrait que la radiothérapie expose également les patients à un risque accru de maladie cardiaque à long terme (17). Tukenova et al. (Tableau 1-c) confirmaient que les patients recevant plus de 5Gy au niveau cardiaque, ainsi que ceux ayant reçu une dose cumulative d’anthracyclines ≥ 360mg/m2 sont à haut risque de mortalité cardiovasculaire. Dans cette cohorte, le taux cumulatif de mortalité d’origine cardiaque et l’incidence cumulative d’insuffisance cardiaque (Figure 1) augmentaient avec le temps, y compris après 20 ans de suivi (7).
| Figure 1: Mortalité observée suite à des pathologies cardiovasculaires (A) et cardiaques (B) dans la cohorte franco-anglaise de patients traités pour un cancer dans l’enfance par rapport à la population générale française et anglaise (7). |
|---|
 |
Il persiste encore des controverses au sujet du seuil de la dose cumulative d’anthracyclines à risque de cardiotoxicité pour les patients. Certains auteurs (Tableau 1-f) ont rapporté que les patients ayant reçu des doses cumulatives d’anthracyclines < 250mg/m2 montrent rarement une détérioration de leur fonction cardiaque (8). A l’inverse et plus récemment, d’autres équipes ont démontré (Tableaux 1-g, 1-h et 1-i) que de faibles doses d’anthracyclines (45 à 250mg/m2) pouvaient entraîner une dysfonction cardiaque avec réduction de la masse ventriculaire gauche (9-11), ce qui suggère que la doxorubicine n’est jamais exempte de toxicité cardiaque.
Conclusions
Le taux de survie de la plupart des cancers de l’enfant s’est amélioré de façon remarquable au cours des dernières décennies (1).
Avec ce succès, il est devenu indispensable de considérer la morbidité et la mortalité associées aux traitements contre le cancer. Les survivants sont en effet à risque de développer toute une série d’effets indésirables (1-3). Parmi ceux-ci, la cardiotoxicité est l’une des complications chroniques les plus graves avec un taux de mortalité élevé, persistant même plusieurs décennies après le traitement.
Dès lors, la réalisation d’enquêtes d’envergure sur les effets secondaires de la chimiothérapie et de la radiothérapie est cruciale. A ce jour, il n’existe pas encore beaucoup de grandes études internationales. Il s’agit essentiellement d’études monocentriques, sur un nombre limité de patients ayant été traités pour une pathologie précise, avec des paramètres de monitoring cardiaque différents et des suivis très variables d’une étude à l’autre. Les résultats de ces études sont donc encore difficiles à comparer.
Au cours des 5 dernières années, les taux de survie n’ont plus considérablement changé. Ces chiffres stables suggèrent que les stratégies de surveillance et de suivi de nos patients ainsi que des traitements novateurs sont maintenant nécessaires pour améliorer les résultats. La recherche clinique doit se concentrer non seulement sur le développement de nouvelles thérapies visant à accroître le taux de survie, mais également à diminuer la gravité des effets secondaires tardifs. Les traitements futurs devraient assurer une vie exempte de séquelles à long terme pour chaque enfant diagnostiqué avec le cancer (1).
Le dépistage, la prévention et le traitement de la cardiotoxicité liée aux traitements du cancer chez l’enfant seront développés dans un prochain article.
RemerciementsCe travail a été soutenu par le Fonds national de la Recherche scientifique (Grant Télévie - FNRS n°7.4637.09), le Fonds national pour la Recherche en Cardiologie pédiatrique, la Fondation Salus Sanguinis et le Centre du Cancer des Cliniques universitaires St-Luc.Références1. Smith MA, Seibel NL, Altekruse SF, et al. Outcomes for children and adolescents with cancer: challenges for the twenty-first century. J Clin Oncol 2010;28:2625-34.
2. Hudson MM. Survivors of childhood cancer: coming of age. Hematol Oncol Clin North Am 2008;22:211-31.
3. Oeffinger KC, Mertens AC, Sklar CA, et al. Chronic health conditions in adult survivors of childhood cancer. N Engl J Med 2006;355:1572-82.
4. Lipshultz SE, Alvarez JA, Scully RE. Anthracycline associated cardiotoxicity in survivors of childhood cancer. Heart 2008;94:525-33.
5. van der Pal HJ, van Dalen EC, Kremer LC, et al. Risk of morbidity and mortality from cardiovascular disease following radiotherapy for childhood cancer: a systematic review. Cancer Treat Rev 2005;31:173-85.
6. Mulrooney DA, Yeazel MW, Kawashima T, et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ 2009;339:b4606.
7. Tukenova M, Guibout C, Oberlin O, et al. Role of cancer treatment in long-term overall and cardiovascular mortality after childhood cancer. J Clin Oncol 2010;28:1308-15.
8. Sorensen K, Levitt GA, Bull C, et al. Late anthracycline cardiotoxicity after childhood cancer: a prospective longitudinal study. Cancer 2003;97:1991-8.
9. Hudson MM, Rai SN, Nunez C, et al. Noninvasive evaluation of late anthracycline cardiac toxicity in childhood cancer survivors. J Clin Oncol 2007;25:3635-43.
10. Rathe M, Carlsen NL, Oxhøj H, et al. Long-term cardiac follow-up of children treated with anthracycline doses of 300mg/m2 or less for acute lymphoblastic leukemia. Pediatr Blood Cancer 2010;54:444-8.
11. Lipshultz SE, Lipsitz SR, Sallan SE, et al. Chronic progressive cardiac dysfunction years after doxorubicin therapy for childhood acute lymphoblastic leukemia. J Clin Oncol 2005;23:2629-36.
12. Amigoni M, Giannattasio C, Fraschini D, et al. Low anthracycline doses-induced cardiotoxicity in acute lymphoblastic leukemia long-term female survivors. Pediatr Blood Cancer 2010;55:1343-7.
13. Möller TR, Garwicz S, Barlow L, et al. Decreasing late mortality among five-year survivors of cancer in childhood and adolescence: a population-based study in the Nordic countries. J Clin Oncol 2001;19:3173-81.
14. Lipshultz SE, Lipsitz SR, Mone SM, et al. Female sex and higher drug dose as risk factors for late cardiotoxic effects of doxorubicin therapy for childhood cancer. N Eng J Med 1995;332:1738-43.
15. Visscher H, Ross CJ, Rassekh SR, et al. Pharmacogenomic prediction of anthracycline-induced cardiotoxicity in children. J Clin Oncol 2011;29:1-12.
16. Adams MJ, Hardenbergh PH, Constine LS, et al. Radiation-associated cardiovascular disease. Crit Rev Oncol Hematol 2003;45(1):55-75.
17. Guldner L, Haddy N, Pein F, et al. Radiation dose and long term risk of cardiac pathology following radiotherapy and anthracycline for a childhood cancer. Radiother Oncol 2006;81:47-56.
18. Kenney LB, Nancarrow CM, Najita J, et al. Health status of the oldest adult survivors of cancer during childhood. Cancer 2010;116:497-505.